開催日時:2011年6月28日(火) 13:50-18:00
会場:(独)産業技術総合研究所 臨海副都心センター 別館11階会議室
〒135-0064東京都江東区青海2-4-7(ゆりかもめテレコムセンター前)
参加者:149名
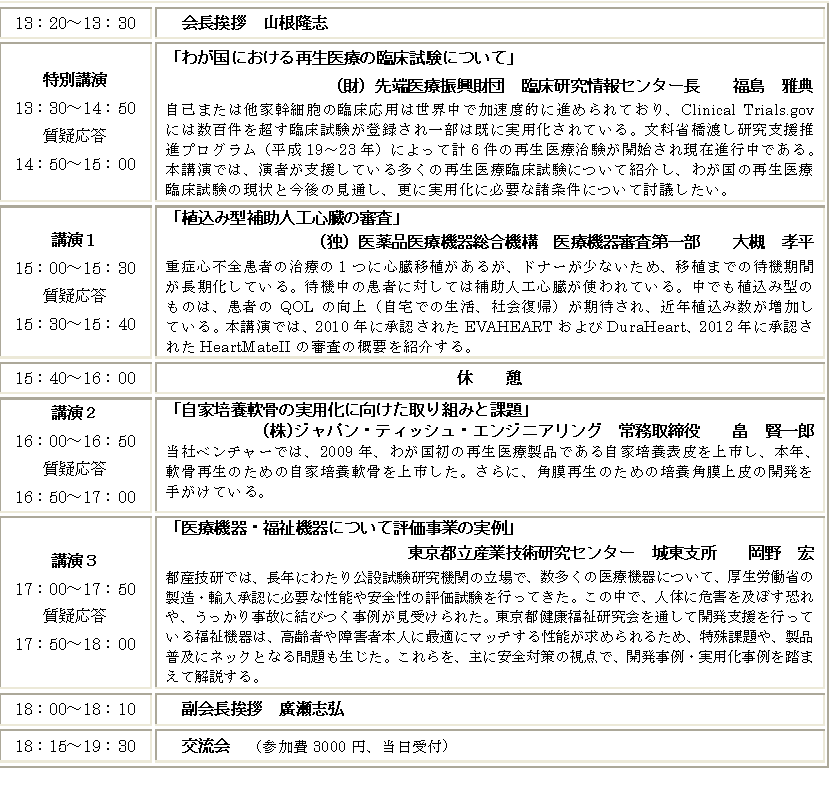
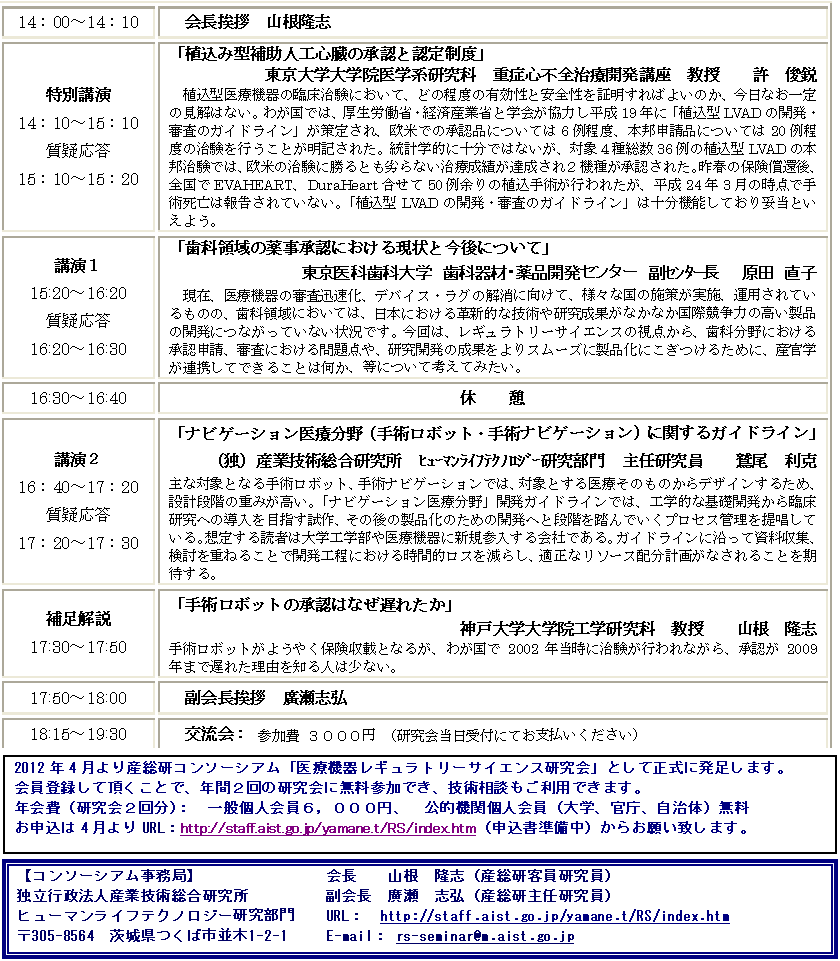
特別講演(特別講演PDF)
慶応義塾大学理工学部教授/日本医工ものつくりコモンズ世話人
谷下 一夫 先生
「日本医工ものつくりコモンズとの連携について」
概要:日本医工ものつくりコモンズでは、医工連携、医療工学・人間中心技 術の開発に携わる人材育成と、医工ものつくり産業に関わる問題点と展望につ いて、工学系の基盤的な各学会の合意により「コモンズ」を設置して意見と情 報を交換し、その上で技術的に意味のある医工連携共同研究開発を推進する体 制の確立へつなげる。(趣意書より)。
講演1(講演1 PDF)
独立行政法人産業技術総合研究所
主幹研究員 山根 隆志
「補助人工心臓の開発から承認までにおける学会の役割」
概要:埋込み型補助人工心臓が2機種、2010年末に承認された。審査が希少 疾病扱いであったほかに、学会協力による申請・審査のためのガイドライン作 り、市販後のための実施基準作りがあって早期承認が達成された、そのロジックを追ってみた。
講演2(講演2 PDF)
独立行政法人産業技術総合研究所
主任研究員 岡崎 義光
「カスタムメイド治療機器の開発ガイドライン(評価指 標)の策定動向」
概要:患者の骨格構造及び症例に最適化したカスタムメイド治療機器(インプ ラント)に関して、厚労省及び経産省の合同事業で、昨年、カスタムメイド骨接 合材料に関する、経産省開発ガイドラインおよび厚労省評価指標通知が公示さ れた。人工股関節も検討中である。カスタムメイド治療機器の開発・申請に有 用な考え方及び試験方法を中心に最近の動向を解説した。
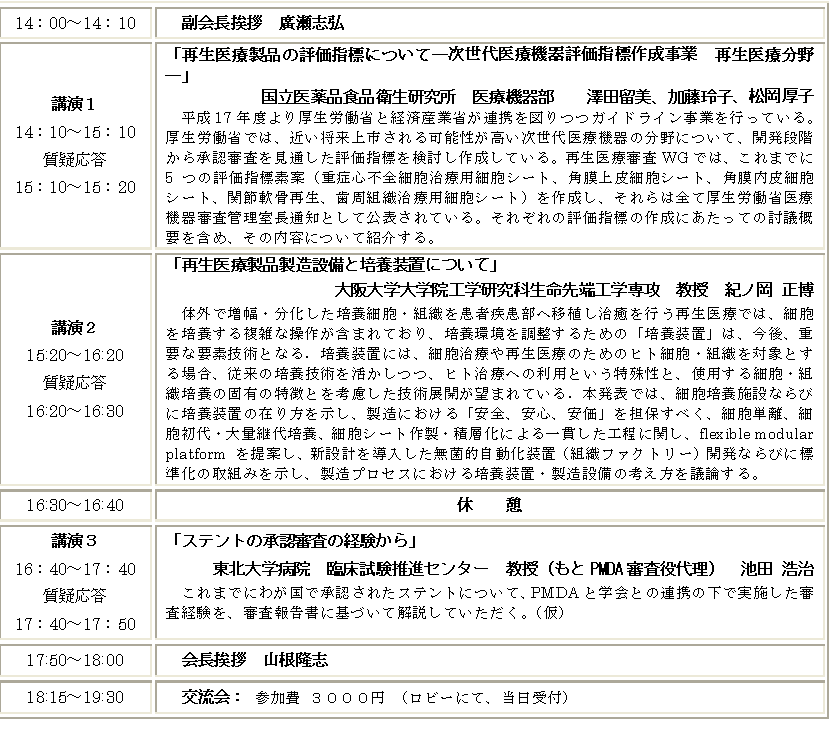
講習(講習 PDF)
独立行政法人産業技術総合研究所 PMDA経験者
山根 隆志・鷲尾 利克
「薬事業務のためのPMDAホームページ活用法」
概要:通知の探し方、承認前例の探し方、新医療機器の審査報告など、PM DAのホームページの活用法、操作法を具体的に紹介した。
情報提供(情報提供 PDF)
独立行政法人産業技術総合研究所
主任研究員 廣瀬 志弘
「再生医療の申請に関する新情報」